ИНСТРУКЦИЯ ПО МЕДИЦИНСКОМУ ПРИМЕНЕНИЮ ПРЕПАРАТА Виктоза® (Victoza®)
Регистрационный номер ЛСР-004405/10-201112
Торговое название: Виктоза®
МНН: Лираглутид
Лекарственная форма
Раствор для подкожного введения
Состав
В 1 мл препарата содержится:
активное вещество: лираглутид 6 мг (в одной предварительно заполненной шприц-ручке объемом 3 мл содержится 18 мг лираглутида);
вспомогательные вещества: натрия гидрофосфата дигидрат 1,42 мг, пропиленгликоль 14,0 мг, фенол 5,5 мг, кислота хлористоводородная/натрия гидроксид q.s., вода для инъекций до 1мл.
Описание
Бесцветный или почти бесцветный прозрачный раствор.
Фармакотерапевтическая группа
Гипогликемическое средство — глюкагоноподобного полипептида рецепторов агонист.
Код АТХ — А10ВХ07.
Фармакологические свойства
Механизм действия
Лираглутид представляет собой аналог человеческого глюкагоноподобного пептида-1 (ГПП-1), произведенный методом биотехнологии рекомбинантной ДНК с использованием штамма Saccharomyces cerevisiae, имеющий 97% гомологичности с человеческим ГПП-1, который связывается и активирует рецепторы ГПП-1 у человека. Рецептор ГПП-1 служит мишенью для нативного ГПП-1 - эндогенного гормона инкретина, вызывающего стимуляцию глюкозозависимой секреции инсулина в бета-клетках поджелудочной железы. В отличие от нативного ГПП-1, фармакокинетический и фармакодинамический профили лираглутида позволяют вводить его пациентам ежедневно один раз в сутки.
Профиль длительного действия лираглутида при подкожной инъекции обеспечивается тремя механизмами: самоассоциацией, в результате которой происходит замедленное всасывание препарата; связыванием с альбумином и более высоким уровнем ферментативной стабильности по отношению к дипептидилпептидазе-4 (ДПП-4) и ферменту нейтральной эндопептидазы (НЭП), за счёт чего обеспечивается длительный период полувыведения препарата из плазмы. Действие лираглутида осуществляется за счёт взаимодействия со специфическими рецепторами ГПП-1, в результате чего повышается уровень циклического аденозинмонофосфата цАМФ. Под действием лираглутида происходит глюкозозависимая стимуляция секреции инсулина и улучшение функции бета-клеток поджелудочной железы. Одновременно лираглутид подавляет излишне высокую глюкозозависимую секрецию глюкагона. Таким образом, при повышении концентрации глюкозы крови происходит стимуляция секреции инсулина и подавление секреции глюкагона, С другой стороны, во время гипогликемии лираглутид снижает секрецию инсулина, но не подавляет секрецию глюкагона. Механизм снижения уровня гликемии включает также небольшую задержку опорожнения желудка, Лираглутид снижает массу тела и уменьшает жировую массу тела при помощи механизмов, вызывающих уменьшение чувства голода и снижение расхода энергии.
Исследования на экспериментальных животных моделях с предиабетом показали, что лираглутид замедляет развитие сахарного диабета. Диагностика in vitro показала, что лираглутид является мощным фактором специфической стимуляции пролиферации бета-клеток поджелудочной железы и предупреждает образование цитокинов и жирных кислот в свободном состоянии, индуцирующих смерть бета-клеток (апоптоз). In vivo, лираглутид повышает биосинтез инсулина и увеличивает массу бета-клеток у экспериментальных животных моделей с диабетом. Когда уровень глюкозы нормализуется, лираглутид перестаёт наращивать массу бета-клеток поджелудочной железы.
Фармакодинамика
Лираглутид обладает длительным 24-часовым действием и улучшает гликемический контроль путём снижения концентрации глюкозы крови натощак и после еды у пациентов с сахарным диабетом 2 типа.
Глюкозозависимая секреции инсулина
При возрастании концентрации глюкозы в крови лираглутид увеличивает секрецию инсулина. При применении поэтапной инфузии глюкозы секреция инсулина после введения однократной дозы лираглутида пациентам с сахарным диабетом 2 типа возрастает до уровня, сопоставимого с таковым у здоровых субъектов (Рис. 1).
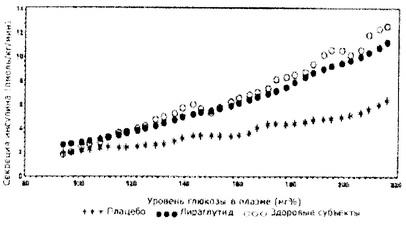
Рисунок 1
Функция бета-клеток поджелудочной железы
Лираглутид улучшал функцию бета-клеток поджелудочной железы, что подтверждается первой и второй фазой инсулинового ответа и максимальной секреторной активностью бета-клеток. Фармакодинамические исследования пациентов с сахарным диабетом 2 типа показали восстановление первой фазы секреции инсулина (внутривенное введение инсулина), улучшение второй фазы секреции инсулина (гипергликемический клэмп-тест) и максимальную секреторную активность инсулина (тест стимуляции аргинином).
В ходе 52-недельной терапии препаратом Виктоза® произошло улучшение функции бета-клеток поджелудочной железы, что подтверждается оценкой гомеостатической модели функции бета-клеток поджелудочной железы (НОМА-индекс) и соотношением инсулина к проинсулину.
Секреция глюкагона:
Лираглутид, стимулируя секрецию инсулина и подавляя секрецию глюкагона, уменьшает уровень глюкозы в крови. Лираглутид не подавляет глюкагоновый ответ на низкую концентрацию глюкозы. Кроме того, на фоне лираглутида наблюдалась более низкая выработка эндогенной глюкозы.
Опорожнение желудка:
Лираглутид вызывает небольшую задержку в опорожнении желудка, снижая, таким образом, интенсивность поступления постпрандиальной глюкозы в кровь.
Масса тела, состав тела и расход энергии:
У субъектов с повышенной массой тела, включённых в долгосрочные клинические исследования лираглутида, последний вызвал значительное снижение веса. Сканирования при помощи методов компьютерной томографии (КТ) и двухэнергетической рентгеновской абсорбциометрии (ДЭРА) показали, что потеря веса произошла в первую очередь из-за потери жировой клетчатки пациентов. Эти результаты объясняются тем, что во время терапии лираглутидом у пациентов снижаются ощущение голода и расход энергии.
Электрофизиология сердца (ЭФс):
Действие лираглутида на процесс реполяризации в сердце было протестировало в исследовании ЭФс. Применение лираглутида в равновесной концентрации в ежедневной дозе до 1,8 мг не продуцирует пролонгацию ЭФс.
Клиническая эффективность
3992 пациента с диабетом 2 типа были рандомизированы в 5 двойных слепых клинических исследованиях по безопасности и эффективности, осуществлённых в целях оценки влияния препарата Виктоза® на гликемический контроль. Терапия препаратом Виктоза® вызвала клинически и статистически значимое улучшение показателя НbА1c глюкозы натощак и постпрандиальной глюкозы по сравнению с плацебо.
Гликемический контроль
Препарат Виктоза® в виде мототерапии в течение 52 недель вызвал статистически значимое (р<0,0014) и продолжительное снижение показателя HbA1c, по сравнению с этим же показателем у пациентов, получавших терапию глимепиридом. При этом, отмеченное снижение НbА1c, ниже уровня 7% сохранялось на протяжении 12 месяцев (Рис. 2).
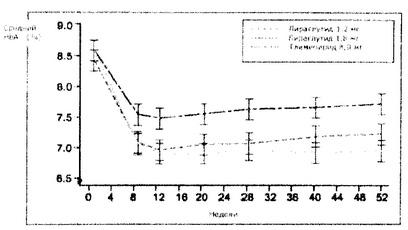
Рисунок 2
У пациентов с НbА1c, выше уровня 9,5% в исходной точке исследования данный показатель снизился на 2,1% на фоне монотерапии препаратом Виктоза®, в то время как у пациентов, участвующих в комбинированных клинических исследованиях препарата Виктоза®, средний уровень НbА1c снизился на 1,1-2,5%.
Препарат Виктоза® в течение 26-недельной комбинированной терапии с метформином, препаратами сульфонилмочевины или метформином и тиазолидиндионом вызвал статистически значимое (р<0,0001) и продолжительное снижение уровня НbА1c, по сравнению с таковым у пациентов, получавших плацебо.
У пациентов, не достигших адекватного гликемического контроля на терапии препаратом Виктоза® и метформином, добавление инсулина детемир обеспечило превосходную эффективность по сравнению с терапией препаратом Виктоза® и метформином после 26 недель лечения (снижение уровня НbА1c на 0,52%).
Было доказано, что эффективность препарата Виктоза® в дозе 0,6 мг в комбинации с препаратами сульфонилмочевины или метформином превосходит плацебо, но в то же время является более низкой, по сравнению с дозировками 1,2 мг и 1,8 мг.
Соотношение пациентов, достигших снижения уровня НbА1c
На фоне монотерапии препаратом Виктоза® в течение 52-недельного исследования число пациентов, достигших уровня НbА1c, < 7%, статистически значимо выросло (p ≤ 0,0007) по сравнению с числом пациентов, получающих глимепирид. На 26 неделе применения препарата Виктоза® в сочетании с метформином, препаратами производных сульфонилмочевины, или комбинацией метформина с тиазолидиндионом, число, пациентов, достигших уровня НbА1c ≤ 6,5%, статистически значимо (р ≤ 0,0001) выросло по отношению к числу пациентов, которые получали терапию одними, без добавления препарата Виктоза®, гипогликемическими препаратами.
В группах пациентов, не достигших адекватного гликемического контроля терапией препаратом Виктоза® и метформином, процентное соотношение пациентов достигших целевого уровня НbА1c (<7% и ≤6,5%) было значительно выше при терапии инсулин детемир + лираглутид 1,8 мг + метформин, по сравнению с терапией лираглутид 1,8 мг + метформин (р ≤ 0,0001 / р=0,0016)
В ходе 26-недельного исследования комбинированного применения препарата Виктоза® удалось достичь уровня НbА1c < 7,0% у большего числа пациентов, получавших препарат в виде комбинированной терапии, по сравнению с числом пациентов, получавших его в виде заместительной терапии.
Уровень гликемии натощак
Уровень глюкозы натощак снизился на 13-43,5 мг% (0,72-2,42 ммоль/л) на фоне приёма препарата Виктоза® как в виде монотерапии, так и в комбинации с одним или двумя пероральными гипогликемическими средствами. Это снижение наблюдалось уже в течение первых двух недель от начала лечения.
Постпрандиальный уровень гликемии
Применение препарата Виктоза® в течение трёх дней приёма стандартной пищи помогло снизить концентрацию постпрандиальной глюкозы на 31-49 мг% (1,68-2,71 ммоль/л).
Масса тела
52-недельная монотерапия препаратом Виктоза® ассоциировалась с устойчивым снижением массы тела.
На протяжении всего периода клинического исследования устойчивое снижение массы тела также ассоциировалось с использованием препарата Виктоза® в комбинации с метформином и в сочетании с комбинациями метформина с производными сульфонилмочевины или метформина с тиазолидиндионом.
Снижение массы тела у пациентов, получающих препарат Виктоза® в комбинации с метформином, также наблюдалось после добавления инсулина детемир.
Наибольшее снижение массы тела наблюдалось у пациентов, имевших в исходной точке исследования повышенный индекс массы тела (ИМТ).
Монотерапия препаратом Виктоза® в течение 52 недель вызвала уменьшение среднего объема талии на 3,0-3,6 см.
Снижение массы тела наблюдалось у всех пациентов, получавших терапию препаратом Виктоза®, независимо от того, испытывали они или нет побочную реакцию в виде тошноты.
Препарат Виктоза® в составе комбинированной терапии с метформином снизил объём подкожно-жировой клетчатки на 13-17%.
Неалкогольный жировой метаморфоз печени
Лираглутид сокращает стеатоз печени у пациентов с сахарным диабетом 2 типа.
Показатели артериального давления
Долгосрочные клинические исследования показали, что препарат Виктоза® снижает показатели с исторического артериального давления в среднем на 2,3-6,7 мм рт.ст. в первые две недели лечения. Снижение с исторического артериального давления наступило до начала уменьшения массы тела.
Другие клинические данные
В сравнительном исследовании эффективности и безопасности препарата Виктоза® (в дозах 1,2 мг и 1,8 мг) и ситаглиптина (ингибитор дипептидилпептидазы —4, в дозе 100 мг) у пациентов, не достигших адекватного контроля на терапии метформином, после 26 недель лечения доказано лучшее снижение уровня НbА1c на препарате Виктоза® в обеих дозах по сравнению с ситаглиптином (-1,24%, -1,50% по сравнению с -0,90%, р < 0,0001). Значительно большее количество пациентов достигает уровня НbА1c ниже 7% на препарате Виктоза® по сравнению с ситаглиптином (43,7% и 56,0% по сравнению с 22 0%, р<0 0001). Снижение веса у пациентов, получающих препарат Виктоза® было значительно выше, по сравнению с пациентами, получающими ситаглиптин (-2,9 кг и -3,4 кг, в сравнении с -1,0 кг, р < 0,0001). По сравнению с пациентами, получающими ситаглиптин, пациенты на препарате Виктоза® чаще жаловались на присутствие побочного эффекта - тошнота. Однако, тошнота была преходящей. Частота случаев легкой гипогликемии незначительно отличалась при лечении препаратом Виктоза® и ситаглиптином (0,178 и 0,161, в сравнении с 0,106 случая/пациента в год). Снижение уровня НbА1c и преимущество препарата Виктоза®, по сравнению с ситаглиптином наблюдалось после 26-ой недели лечения препаратом Виктоза® (1,2 мг и 1,8 мг) и подтверждалась после 52-ой недели лечения (-1,29% и -1,51% в сравнении с -0,88%, р<0,0001). Через 52 недели применения ситаглиптина пациенты были переведены на препарат Виктоза®, что привело к дополнительному и статистически значимому снижению уровня НbА1c на 78-ой неделе лечения (0,24% и 0,45%, 95 Cl: от 0,41 до 0,07 и от -0,67 до 0,23).
В сравнительном исследовании эффективности и безопасности препарата Виктоза® (в дозе 1,8 мг) и эксенатида (в дозе 10 мкг два раза в день) у пациентов, не достигших адекватного контроля на терапии метформином и/или производными сульфонилмочевины, после 26 недель лечения препарат Виктоза® показал лучшее снижение уровня НbА1c по сравнению с эксенатидом (1,12% в сравнении с -0,79%, р<0,0001). Значительно большее количество пациентов достигает уровня НbА1c ниже 7% на терапии препаратом Виктоза® по сравнению с эксенатидом (54,2% по сравнению с 43,4%, р=0,0015). Обе терапии показали среднюю потерю массы тела приблизительно 3 кг. Количество пациентов, сообщавших о побочном явлении - тошнота, было ниже в группе пациентов, получающих препарат Виктоза®, по сравнению с эксенатидом. Частота случаев легкой гипогликемии была значительно ниже в группе пациентов, получающих препарат Виктоза®, по
сравнению с эксенатидом (1 932 в сравнении с 2 600 случая/пациента в год, р=0,01). Через 26 недель применения эксенатида пациенты были переведены на препарат Виктоза®, что привело к дополнительному снижению уровня НbА1c на 40-ой неделе лечения (0,32%, р<0,0001), 13% пациентов удалось достичь уровня НbА1c ниже 7%.
Терапия препаратом Виктоза® в течение 52 недель улучшила инсулиночувствительность по сравнению с таковой у препаратов сульфонилмочевины, что было выявлено при помощи гомеостатической модели оценки инсулинрезистентности НОМА-IR.
Фармакокинетика
Абсорбция
Всасывание лираглутида после подкожного введения происходит медленно, время достижения максимальной концентрации в плазме — 8-12 часов после введения дозы препарата.Максимальная концентрация (Сmax) лираглутида в плазме после подкожной инъекции в однократной дозе 0,6 мг составляет 9,4 нмоль/л. При введении лираглутида в дозе 1,8 мг средний показатель его равновесной концентрации в плазме (AUCт/24) достигает приблизительно 34 нмоль/л. Экспозиция лираглутида (подвергание воздействию препарата) усиливается пропорционально введённой дозе. После введения лираглутида в однократной дозе внутрипопуляционный коэффициент вариации площади под кривой «концентрация-время» AUC составляет 11%. Абсолютная биодоступность лираглутида после подкожного введения составляет приблизительно 55%.
Распределение
Кажущийся объём распределения лираглутида в тканях после подкожного введения составляет 11-17 л. Средний объём распределения лираглутида после внутривенного введения составляет 0,07 л/кг. Лираглутид в значительной степени связывается с белками плазмы крови (>98%).
Метаболизм
На протяжении 24 часов после введения здоровым добровольцам однократной дозы меченного радиоактивным изотопом [3Н]-лираглутида главным компонентом плазмы оставался неизменённый лираглутид. Были обнаружены два метаболита в плазме (≤ 9% и ≤ 5% от уровня общей радиоактивности в плазме крови). Лираглутид метаболизируется эндогенно подобно крупным белкам, без привлечения какого-либо специфического органа в качестве пути выведения.
Выведение
После введения дозы [3Н]-лираглутида, неизменённый лираглутид не определялся в моче или кале. Лишь незначительная часть введённой радиоактивности в виде связанных с лираглутидом метаболитов (6% и 5% соответственно) выводилась почками или через кишечник. Радиоактивные вещества почками или через кишечник выводятся, в основном, в течение первых 6-8 дней после введения дозы препарата, и представляют собой три метаболита. Средний клиренс из организма после подкожного введения лираглутида в однократной дозе составляет приблизительно 1,2 л/ч с элиминационным периодом полувыведения примерно 13 часов.
Особые группы пациентов
Пожилой возраст: Данные фармакокинетических исследований в группе здоровых добровольцев и анализ фармакокинетических данных, полученных в популяции пациентов (от 18 до 80 лет), свидетельствуют о том, что возраст не оказывает клинически значимого эффекта на фармакокинетические свойства лираглутида.
Пол: Популяционный фармакокинетический анализ данных, полученных при исследовании действия лираглутида у пациентов женского и мужского полов, и данные фармакокинетических исследований в группе здоровых добровольцев свидетельствуют о том, что пол не оказывает клинически значимого эффекта на фармакокинетические свойства лираглутида.
Этническая принадлежность: Популяционный фармакокинетический анализ данных, полученных при исследовании действия лираглутида у субъектов белой, чёрной, азиатской и латиноамериканской расовых групп, свидетельствует о том, что этническая принадлежность не оказывает клинически значимого эффекта на фармакокинетические свойства лираглутида.
Ожирение: Популяционный фармакокинетический анализ данных свидетельствует о том, что индекс массы тела (ИМТ) не оказывает клинически значимого эффекта на фармакокинетические свойства лираглутида.
Печёночная недостаточность:
Фармакокинетические свойства лираглутида исследовались в ходе клинического исследования однократной дозы препарата у субъектов с различной степенью печеночной недостаточности. Пациенты с легкой печеночной недостаточностью (по классификации Child Pugh тяжесть заболевания 5 - 6 баллов) и тяжёлой печеночной недостаточностью (по классификации Child Pugh тяжесть заболевания > 9 баллов) были включены в исследования. Экспозиция лираглутида в группе пациентов с нарушениями функции печени было не выше, чем таковое в группе здоровых субъектов, что указывает на то, что печеночная недостаточность не оказывает клинически значимого эффекта на фармакокинетику лираглутида.
Почечная недостаточность:
Фармакокинетика лираглутида изучалась у пациентов с различной степенью почечной недостаточности в исследовании однократной дозы. В данное исследование были включены субъекты с различной степенью почечной недостаточности: от лёгкой (оценка клиренса креатинина 50-80 мл/мин) до тяжёлой (оценка клиренса креатинина <30 мл/мин) и субъекты с терминальной стадией почечной недостаточности, нуждающиеся в гемодиализе. Почечная недостаточность не оказала клинически значимого эффекта на фармакокинетику лираглутида.
Дети:
Исследование препарата Виктоза® у детей не проводилось.
Данные доклинического исследования безопасности
Результаты фармакологических доклинических исследований введения повторных доз препарата в отношении токсичности, в том числе генотоксичности, показали, что применение лираглутида не создаёт угрозы для здоровья людей.
Опухоли С-клеток щитовидной железы крыс и мышей были выявлены в ходе двухлетних исследований онкогенности лекарственного препарата на грызунах и не приводили к летальному исходу. Уровень отсутствия проявляющихся побочных эффектов (NOAEL) у крыс не отмечен. Появление подобных опухолей у обезьян, получавших терапию лираглутидом в течение 20 месяцев, не отмечалось. Результаты, полученные в ходе исследований на грызунах, связаны с тем, что грызуны проявляют особую чувствительность в отношении опосредуемого рецептором ГПП-1 не генотоксичного специфического механизма. Значимость полученных данных для человека является низкой, однако не может быть полностью исключена. Появления каких-либо других новообразований, связанных с проводимой терапией, не отмечалось.
В исследованиях на животных не выявлено прямого неблагоприятного эффекта препарата на фертильность, но отмечено незначительное увеличение частоты ранней эмбриональной смерти при лечении самой высокой дозой препарата. Введение препарата Виктоза® крысам в середине периода беременности вызвало у них сокращение массы тела матери и роста эмбриона с до конца не изученным эффектом на рёбра, а в группе кроликов-отклонения в скелетной структуре. Рост новорождённых особей в группе крыс во время терапии препаратом Виктоза® снизился, и это снижение устойчиво сохранялось в период после окончания грудного вскармливания в группе моделей, получавших высокие дозы лираглутида. Неизвестно, чем обусловлено такое снижение роста новорождённых особей крыс снижением потребления ими материнского молока вследствие прямого влияния ГПП-1, либо недостаточным уровнем выработки грудного молока материнскими особями крыс.
Показания к применению
Препарат Виктоза® показан в качестве вспомогательного средства на фоне диеты и физических упражнений для достижения гликемического контроля у взрослых пациентов с сахарным диабетом 2 типа. Препарат Виктоза® показан для применения один раз в день в качестве:
- Монотерапии
- Комбинированной терапии с одним или несколькими пероральными сахароснижающими препаратами (с метформином, производными сульфонилмочевины или тиазолидиндионами), у пациентов, не достигших адекватного гликемического контроля на предшествующей терапии.
- Комбинированной терапии с базальным инсулином у пациентов, не достигших адекватного гликемического контроля на терапии препаратом Виктоза® и метформином.
Противопоказания
Повышенная чувствительность к активному веществу или другим компонентам, входящим в состав препарата. Беременность и период грудного вскармливания (см. раздел «Применение при беременности и в период грудного вскармливания»).
Препарат не следует использовать у пациентов с сахарным диабетом 1 типа; при диабетическом кетоацидозе (см. раздел «Особые указания»).
Не рекомендуется применять у пациентов с тяжёлыми нарушениями функции почек; нарушениями функции печени; сердечной недостаточностью III-IV функционального класса (в соответствии с классификацией NYHA (Нью-Йоркская кардиологическая ассоциация)); воспалительными заболеваниями кишечника; парезом желудка (см. раздел «Особые указания»); у детей младше 18 лет (см. раздел «Способ применения и дозы»).
С осторожностью
В связи с ограниченным опытом применения рекомендуется применять с осторожностью у пациентов с сердечной недостаточностью I-II функционального класса (в соответствии с классификацией NYHA); нарушениями функции почек средней степени тяжести; в возрасте 75 лет и старше (см. разделы «Особые указания», «Способ применения и дозы»).
Применение при беременности и в период грудного вскармливания
Беременность
Адекватные данные по применению препарата Виктоза® у беременных женщин отсутствуют. Исследования на животных продемонстрировали репродуктивную токсичность препарата (см. раздел Данные доклинического испытания безопасности).
Потенциальный риск для людей неизвестен.
Препарат Виктоза® нельзя использовать во время беременности, вместо него рекомендуется проводить лечение инсулином. Если пациентка готовится к беременности, либо беременность уже наступила, терапию препаратом Виктоза® необходимо немедленно прекратить.
Период кормления грудью
Неизвестно, выделяется ли лираглутид с грудным молоком женщин. Исследования на животных показали, что проникновение лираглутида и метаболитов близкой структурной связи в грудное молоко является низким. Опыт применения препарата Виктоза® у кормящих женщин отсутствует; применение препарата в период грудного вскармливания противопоказано.
Способ применения и дозы
Препарат Виктоза® используют один раз в сутки в любое время, независимо от приёма пищи, его можно вводить в виде подкожной инъекции в живот, бедро или плечо. Место и время инъекции могут изменяться без коррекции дозы. Однако предпочтительнее вводить препарат приблизительно в одно и то же время суток, в наиболее удобное для пациента время. Дальнейшая информация по способу применения препарата Виктоза® содержится в разделе «Руководство по использованию». Препарат Виктоза® нельзя использовать для внутривенного и внутримышечного введения.
Дозы
Начальная доза препарата составляет 0,6 мг лираглутида в день. После применения препарата в течение минимум одной недели дозу следует увеличить до 1,2 мг. Есть данные о том, что у некоторых пациентов эффективность лечения возрастает при увеличении дозы препарата с 1,2 мг до 1,8 мг. С целью достижения наилучшего гликемического контроля у больного и с учётом клинической эффективности дозу препарата Виктоза® можно увеличить до 1,8 мг после применения его в дозе 1,2 мг в течение минимум одной недели. Применение препарата в ежедневной дозе выше 1,8 мг не рекомендуется.
Препарат Виктоза® рекомендуется применять дополнительно к существующей терапии метформином или комбинированной терапии метформином с тиазолидиндионом. Терапию метформином и тиазолидиндионом можно продолжить в прежних дозах.
Препарат Виктоза® рекомендуется добавлять к проводимой терапии производными сульфонилмочевины или к комбинированной терапии метформином с производными сульфонилмочевины. При добавлении препарата Виктоза® к терапии производными сульфонилмочевины следует учитывать снижение дозы производных сульфонилмочевины с целью минимизации риска возникновения нежелательных гипогликемий (см. раздел «Особые указания»).
Для коррекции дозы препарата Виктоза® не требуется проведения самоконтроля глюкозы крови. Однако, в начале терапии препаратом Виктоза® в комбинации с производными сульфонилмочевины, такой самоконтроль глюкозы крови может потребоваться для коррекции дозы производных сульфонилмочевины.
Особые грунты пациентов
Пожилой возраст (>65 лет): Не требуется подбора дозы в зависимости от возраста. Имеется ограниченный опыт применения препарата у пациентов в возрасте 75 лет и старше (см. подраздел «Фармакокинетика»).
Пациенты с почечной недостаточностью
Не требуется подбора дозы для пациентов, страдающих почечной недостаточностью лёгкой формы. Имеется ограниченный опыт применения препарата у пациентов с умеренной почечной недостаточностью. В настоящее время применение препарата Виктоза® у пациентов с тяжёлыми нарушениями функции почек, в том числе у больных с терминальной стадией почечной недостаточности, противопоказано (см. подраздел «Фармакокинетика»).
Пациенты с печёночной недостаточностью
В настоящее время имеется ограниченный опыт применения препарата Виктоза® у пациентов с печеночной недостаточностью, поэтому противопоказано использовать его у пациентов, страдающих печеночной недостаточностью лёгкой, умеренной или тяжёлой степени (см. подраздел «Фармакокинетика»).
Дети и подростки
Отсутствие данных по применению препарата Виктоза® у пациентов, не достигших 18-летнего возраста, не позволяет рекомендовать его для лечения больных данной группы.
Побочное действие
В ходе клинических исследований наиболее часто сообщалось о побочных эффектах со стороны желудочно-кишечного тракта: тошнота и диарея (зарегистрировано у > 10% пациентов); рвота, запор, боли в области живота и диспепсические явления (зарегистрировано у ≥ 1%, но ≤ 10% пациентов).
В начале терапии препаратом Виктоза® указанные желудочно-кишечные побочные явления могут встречаться чаще, но по мере продолжения лечения реакции обычно уменьшаются в течение нескольких дней или недель. Побочные реакции в виде головной боли и инфекций верхних дыхательных путей наблюдались относительно часто (1-10% пациентов). Кроме того, возможно развитие гипогликемических состояний, особенно при применении препарата Виктоза® в сочетании с производными сульфонилмочевины (зарегистрировано у > 10% пациентов). Тяжелые гипогликемии главным образом развиваются на фоне комбинированного приёма препарата Виктоза® с производными сульфонилмочевины.
О серьезных побочных эффектах сообщалось очень редко.
В Таблице 1 приведены сведения о побочных эффектах, выявленных в ходе долгосрочных контролируемых клинических исследований III фазы препарата Виктоза® и при спонтанных (постмаркетинговых) сообщениях. Представлены побочные реакции, выявленные в ходе долгосрочных клинических исследований III фазы с частотой развития >5% при условии, что их частота была выше в группе пациентов, получающих препарат Виктоза®, по сравнению с таковой в группе пациентов, получающих препараты сравнения. Также включены побочные реакции с частотой развития ≥1%, при условии, что их частота была в 2 и более раз выше частоты побочных реакций в группах пациентов, получающих терапию препаратами сравнения.
Частота остальных спонтанных (постмаркетинговых) сообщений была рассчитана исходя из их встречаемости в ходе клинических исследований III фазы.
Все представленные ниже побочные реакции, основанные на данных, полученных в ходе клинических исследований и в постмаркетинговом периоде, распределены по группам согласно частоте развития в соответствии с MedDRA и системами органов. Частота развития побочных реакций определена как: очень часто (≥ 1/10); часто (≥ 1/100 до <1/10); нечасто (≥1/1000 до <1/100); редко (≥1/10000 до <1/1000).
Таблица 1 Побочные реакции, выявленные в ходе долгосрочных плацебо-контролируемых клинических исследований III фазы и спонтанных (постмаркетинговых) сообщений
| Органы и системы/ побочные реакции | Частота развития | |
| III фаза исследований | Спонтанные сообщения | |
| Нарушения метаболизма и питания | ||
| Гипогликемия | Часто | |
| Анорексия | Часто | |
| Снижение аппетита | Часто | |
| Нарушения со стороны нервной системы | ||
| Головная боль | Часто | |
| Нарушения со стороны желудочно-кишечного тракта | ||
| Тошнота | Очень часто | |
| Диарея | Очень часто | |
| Рвота | Часто | |
| Диспепсия | Часто | |
| Боли в верхней части живота | Часто | |
| Запор | Часто | |
| Гастрит | Часто | |
| Метеоризм | Часто | |
| Вздутие живота | Часто | |
| Гастроэзофагеальный рефлюкс | Часто | |
| Отрыжка | Часто | |
| Нарушения иммунной системы | ||
| Анафилактические реакции | Редко | |
| Инфекции и инвазии | ||
| Инфекции верхних дыхательных путей | ||
| Часто | ||
| Общие расстройства и реакции в местах введения | ||
| Недомогание | Нечасто | |
| Реакции в местах введения | Часто | |
| Нарушения со стороны почек и мочевыводящих путей | ||
| Острая почечная недостаточность # | Нечасто | |
| Нарушения функции почек # | Нечасто | |
| Нарушения обмена веществ и питания | ||
| Обезвоживание # | Нечасто | |
| Нарушения со стороны кожи и подкожных тканей | ||
| Крапивница | Нечасто | |
| Сыпь | Часто | |
| Зуд | Нечасто | |
N= 2501 пациенты, получающие терапию препаратом Виктоза®
# см. раздел «Особые указания»
Описание отдельных побочных реакций
Гипогликемия
Большинство эпизодов подтверждённой гипогликемии, зарегистрированных в ходе клинических исследований, были легкими.
Во время клинических исследований при применении препарата Виктоза® в виде монотерапии не отмечено случаев возникновения тяжёлой гипогликемии. Тяжёлые гипогликемии могут возникать нечасто и главным образом, наблюдаются при применении препарата Виктоза® в комбинации с производными сульфонилмочевины (0,02 случая/пациента в год). При применении препарата Виктоза® в сочетании с другими пероральными гипогликемическими препаратами (не производными сульфонилмочевины) развитие гипогликемии наблюдалось очень редко (0,001 случаев/пациента в год).
В ходе терапии лираглутидом в дозе 1,8 мг в сочетании с инсулином детемир и метформином не было отмечено случаев тяжелых гипогликемий. Частота случаев легкой гипогликемии составила 0,228 случая/пациента в год. В группах пациентов, получавших терапию лираглутидом 1,8 мг и метформином, частота случаев легкой гипогликемии составила 0,034 и 0,115 случая/пациента в год, соответственно.
Побочные реакции со стороны желудочно-кишечного тракта
В большинстве случаев тошнота имела лёгкий или умеренный характер, была преходящей и редко приводила к отмене терапии.
Процент пациентов с побочными реакциями в виде тошноты (по неделям) в долгосрочном клиническом исследовании приведено на Рис. 3.
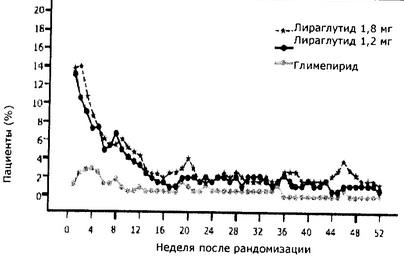
Рисунок 3
20,7% пациентов, получавших препарат Виктоза® в комбинации с метформином, перенесли минимум один эпизод тошноты, а 12,6% - по крайней мере, один эпизод диареи. При приёме препарата Виктоза® в комбинации с производными сульфонилмочевины у 9,1% пациентов отмечен минимум один эпизод тошноты, и у 7,9% - по крайней мере, по одному случаю развития диареи.
В ходе долгосрочных контролируемых клинических исследований (26 недель или более) частота прекращения участия пациентов в исследовании из-за развития побочных эффектов составила 7,8% в группе пациентов, получающих препарат Виктоза®, и 3,4% в группе пациентов, получающих препараты сравнения. Наиболее частыми побочными реакциями, которые приводили к отмене препарата Виктоза®, были тошнота (2,8% пациентов) и рвота (1,5%).
У пациентов в возрасте старше 70 лет частота развития побочных реакций со стороны желудочно-кишечного тракта при применении препарата Виктоза® может быть выше.
При применении препарата Виктоза® у пациентов с лёгкой степенью почечной недостаточности (клиренс креатинина ≤ 60-90 мл/мин) частота побочных реакций со стороны желудочно-кишечного тракта может быть выше.
Иммуногенность
Учитывая возможность иммуногенного влияния белковых и пептидных лекарственных препаратов, применение препарата Виктоза® у пациентов может привести к образованию антител к лираглутиду. Образование антител отмечается в среднем у 8,6% пациентов. Образование антител не приводит к снижению эффективности препарата Виктоза®.
Реакции в месте введения
В ходе долгосрочных (26 недель или более) контролируемых исследований приблизительно у 2% пациентов, получавших препарат Виктоза®, отмечались реакции в месте введения препарата. Эти реакции носили, как правило, лёгкий характер.
Панкреатит
Сообщалось о нескольких случаях развития острого панкреатита (<0,2%) в ходе долгосрочных клинических исследований. Имеются сообщения о случаях развития панкреатита в пострегистрационном периоде. Частота развития панкреатита не отличается от таковой в данной популяции (пациенты с сахарным диабетом 2 типа). Данные, позволяющие подтвердить или опровергнуть причинно-следственную взаимосвязь развития панкреатита с приёмом препарата Виктоза® отсутствуют.
Побочные реакции со стороны щитовидной железы
Общая частота побочных реакций со стороны щитовидной железы во всех промежуточных и долгосрочных клинических исследованиях при применении лираглутида, плацебо и препаратов сравнения составляет 33,5, 30,0 и 21,7 случаев на 1000 пациента-лет суммарного воздействия, соответственно; а частота развития серьёзных побочных реакций — соответственно 5,4, 2,1 и 1,2 случаев.
Наиболее частыми побочными эффектами со стороны щитовидной железы были новообразования щитовидной железы, повышение концентрации кальцитонина в сыворотке крови и зоб. Частота этих явлений на 1000 пациента-лет воздействия составила 6,8, 10,9 и 5,4 случаев, соответственно, у пациентов, получавших лираглутид, по сравнению с 6,4, 10,7 и 2,1 случаев — у пациентов, получавших плацебо, и 2,4, 6,0 и 1,8 случаев — у пациентов, получавших препараты сравнения.
Аллергические реакции
В пострегистрационном периоде сообщалось о возникновении аллергических реакций, таких как крапивница, сыпь и зуд.
В пострегистрационном периоде при приеме препарата Виктоза® описано несколько случаев анафилактических реакций, сопровождаемых такими симптомами как гипотония, учащенное сердцебиение, одышка, отек.
Передозировка
В ходе клинических исследований и постмаркетинговом периоде сообщалось о случаях применения препарата Виктоза® в дозах, до 40 раз превышающих среднюю рекомендуемую дозу (72 мг), что сопровождалось развитием тяжелой тошноты и рвоты. Случаев тяжелой гипогликемии не отмечалось. Все пациенты выздоровели полностью без осложнений. В случае передозировки препарата Виктоза® рекомендуется проведение соответствующей симптоматической терапии.
Взаимодействие с другими лекарственными средствами
Оценка взаимодействия лекарственных средств in vitro
Лираглутид показал очень низкую способность к лекарственному фармакокинетическому взаимодействию, обусловленному метаболизмом в системе цитохрома Р-450 (CYP), а также связыванием с белками плазмы.
Оценка взаимодействия лекарственных средств in vivo
Небольшая задержка опорожнения желудка при применении лираглутида, может оказывать влияние на всасывание сопутствующих лекарственных препаратов, предназначенных для приема внутрь. Исследования лекарственного взаимодействия не показали какого-либо клинически значимого замедления всасывания этих препаратов. У нескольких пациентов, получавших лечение препаратом Виктоза®, отмечалось минимум по одному эпизоду острой диареи. Диарея может оказывать влияние на всасывание пероральных лекарственных препаратов, которые используются одновременно с препаратом Виктоза®.
Парацетамол
Однократное применение парацетамола в дозе 1000 мг на фоне использования лираглутида не вызывает изменение системной экспозиции. Сmax парацетамола в плазме снизилась на 31%, а среднее время достижения максимальной концентрации в плазме крови tmax увеличилось на 15 минут. При одновременном приёме лираглутида и парацетамола коррекции дозы последнего не требуется.
Аторвастатин
Однократное применение аторвастатина в дозе 40 мг на фоне использования лираглутида не вызывает изменение системной экспозиции. Таким образом, на фоне приёма препарата Виктоза® коррекции дозы аторвастатина не требуется. Сmax аторвастатина в плазме снизилась на 38%, а среднее значение tmax в плазме на фоне приёма лираглутида увеличилось с 1 до 3 часов.
Гризеофульвин
Однократное применение гризеофульвина в дозе 500 мг на фоне использования лираглутида не вызывает изменение системной экспозиции. Сmax гризеофульвина возросла на 37%, в то время как среднее значение tmax в плазме не изменилось. Коррекции дозы гризеофульвина и других лекарственных средств, имеющих низкую растворимость и высокую проницаемость, не требуется.
Дигоксин
При одновременном однократном введении дигоксина в дозе 1 мг и лираглутида отмечалось уменьшение площади под кривой AUC дигоксина на 16%; Сmax дигоксина снизилась на 31%. Среднее значение дигоксина в плазме увеличилось с 1 до 1,5 часов. Исходя из полученных результатов, коррекция дозы дигоксина на фоне приёма лираглутида не требуется.
Лизиноприл
Однократное применение лизиноприла в дозе 20 мг на фоне использования лираглутида привело к уменьшению площади под кривой AUC лизиноприла на 15%; Сmax лизиноприла снизилась на 27%. Среднее значение лизиноприла в плазме на фоне приёма лираглутида увеличилось с 6 до 8 часов. Исходя из полученных результатов, коррекция дозы лизиноприла на фоне приёма лираглутида не требуется.
Пероральные контрацептивы
Сmax этинилэстрадиола и левоноргестрела после их однократного применения на фоне терапии лираглутидом снизилась на 12% и 13%, соответственно. Применение обоих препаратов вместе с лираглутидом сопровождалось увеличением tmax этих лекарственных средств на 1,5 часа. Клинически значимого эффекта на системную экспозицию этинилэстрадиола и левоноргестрела в организме лираглутид не оказывает. Таким образом, ожидаемый контрацептивный эффект обоих лекарственных средств на фоне терапии лираглутидом не изменяется.
Варфарин и другие производные кумарина
Исследования по взаимодействию не проводились. В начале лечения препаратом Виктоза® у пациентов, получающих варфарин или другие производные кумарина, рекомендуется чаще проводить мониторинг Международного нормализованного отношения (МНО).
Инсулин
Не было выявлено фармакокинетического или фармакодинамического взаимодействия лираглутида с инсулином детемир, при однократном применении инсулина детемир в дозе 0,5 ЕД/кг с лираглутидом в дозе 1,8 мг у пациентов с сахарным диабетом 2 типа.
Несовместимость
Вещества, добавленные к препарату Виктоза®, могут вызвать деградацию лираглутида. Препарат Виктоза® нельзя смешивать с другими лекарственными средствами, в том числе с инфузионными растворами.
Особые указания
Препарат Виктоза® не следует использовать у пациентов с сахарным диабетом 1 типа или для лечения диабетического кетоацидоза.
Виктоза® не заменяет инсулин.
Назначение лираглутида у пациентов, уже получающих инсулин, не изучалось.
Опыт применения препарата Виктоза® у пациентов с сердечной недостаточностью I-II функциональных классов в соответствии с функциональной классификацией хронической сердечной недостаточности NYHA ограничен. Отсутствует опыт применения препарата Виктоза® у пациентов с сердечной недостаточностью III-IV функциональных классов в соответствии с классификацией хронической сердечной недостаточности NYHA.
Опыт применения препарата Виктоза® у пациентов с воспалительными заболеваниями кишечника и диабетическим парезом желудка ограничен; поэтому применение препарата Виктоза® в данных группах больных не рекомендуется. Применение препарата Виктоза® ассоциируется с развитием преходящих побочных реакций со стороны желудочно-кишечного тракта, таких как тошнота, рвота и диарея.
Применение других агонистов ГПП-1 ассоциировалось с риском развития панкреатита. Сообщалось о нескольких случаях острого панкреатита. Пациенты должны быть информированы о характерных симптомах острого панкреатита: постоянные сильные боли в области живота. При подозрении на панкреатит терапия препаратом Виктоза® и другими потенциально опасными лекарственными средствами должна быть немедленно прекращена.
В ходе клинических исследований препарата Виктоза® у отдельных пациентов (в частности, у пациентов, уже имеющих заболевания щитовидной железы) сообщалось о побочных явлениях со стороны щитовидной железы, включая повышение концентрации кальцитонина в сыворотке крови, зоб и новообразования щитовидной железы (см. раздел Побочное действие).
В ходе проведения клинических исследований сообщалось о появлении признаков и симптомов дегидратации и почечной недостаточности у пациентов, принимавших препарат Виктоза®. Пациенты, получающие препарат Виктоза®, должны быть предупреждены о возможном риске обезвоживания в связи с побочными эффектами со стороны желудочно-кишечного тракта и о необходимости соблюдения ими мер предосторожности, чтобы избежать развития гиповолемии.
Пациенты, получающие препарат Виктоза® в комбинации с производными сульфонилмочевины, имеют повышенный риск развития гипогликемии (см. раздел Побочное действие). Риск развития гипогликемии можно снизить, уменьшив дозу производных сульфонилмочевины.
Влияние на способность управлять транспортными средствами и работу с механизмам
Исследований о влиянии препарата Виктоза® на способность управления транспортными средствами и работу с механизмами не проводилось. Маловероятно, что лираглутид может влиять на способность управления транспортными средствами или работу с механизмами. Пациенты должны быть предупреждены о том, что им следует соблюдать меры предосторожности во избежание развития у них гипогликемии во время управления транспортных средств и при работе с механизмами, особенно при применении Виктоза® в комбинации с производными сульфонилмочевины.
Руководство по использованию
Препарат Виктоза® нельзя использовать, если он выглядит иначе, чем прозрачная и бесцветная или почти бесцветная жидкость.
Препарат Виктоза® нельзя использовать, если он подвергся замораживанию.
Препарат Виктоза® можно вводить при помощи игл длиной до 8 мм и толщиной до 32G. Шприц-ручка предназначена для использования в комбинации с одноразовыми инъекционными иглами НовоФайн® или НовоТвист®.
Инъекционные иглы не включены в упаковку.
Пациент должен быть проинформирован о том, что использованную иглу следует выбрасывать после каждой инъекции, а также о том, что нельзя хранить шприц-ручку с присоединенной иглой. Такая мера позволит предотвратить загрязнение, инфицирование и утечку препарата из шприц-ручки и гарантирует точность дозирования.
Форма выпуска
Раствор для подкожного введения 6 мг/мл. По 3 мл в картридж из стекла 1 гидролитического класса, укупоренный диском из бромбутиловой резины/полиизопрена с одной стороны и поршнем из бромбутиловой резины с другой. Картридж запаян в пластиковую одноразовую шприц-ручку для многократных инъекций. По 1, 2 или 3 пластиковых одноразовых шприц-ручки для многократных инъекций вместе с инструкцией по применению в картонной пачке.
В каждой шприц-ручке (3 мл) содержится 30 доз по 0,6 мг, 15 доз по 1,2 мг или 10 доз по 1,8 мг лираглутида.
Срок годности
30 месяцев. Не использовать по истечении срока, указанного на этикетке шприц-ручки и упаковке.
Условия хранения
Хранить в недоступном для детей месте.
Хранить при температуре от 2°С до 8°С (в холодильнике). Не замораживать.
Для шприц-ручки, находящейся в использовании: использовать в течение 1 месяца.
Хранить при температуре не выше 30°С или от 2°С до 8°С (в холодильнике). Не замораживать. Закрывать шприц-ручку колпачком для защиты от света.
Условия отпуска из аптек
По рецепту.
Производитель
Ново Нордиск А/С
Ново Алле, DK-2880 Багсваерд, Дания
Представительство
«Ново Нордиск А/С»
119330, Москва,
Ломоносовский проспект, 38, офис 11
Тел.: (495) 956-11-32
Факс: (495) 956-50-13
Виктоза®, НовоФайн® и НовоТвист® - зарегистрированные торговые марки, принадлежащие компании Ново Нордиск А/С, Дания
ИНСТРУКЦИЯ ДЛЯ ПАЦИЕНТОВ ПО ИСПОЛЬЗОВАНИЮ ШПРИЦ-РУЧКИ ВИКТОЗА®
Перед началом использования шприц ручки Виктоза® следует тщательно изучить указанную инструкцию.
Шприц-ручка Виктоза® содержит 18 мг лираглутида. Вы можете выбрать любую из трёх возможных дозировок: 0,6 мг, 1,2 мг и 1,8 мг.
Шприц-ручка Виктоза® предназначена для использования в комбинации с одноразовыми иглами НовоФайн® или НовоТвист® длиной до 8 мм и толщиной до 32G.
Шприц-ручка Виктоза®
Подготовка Вашей шприц-ручки Виктоза® к инъекции
А Снимите колпачок со шприц-ручки.
В Снимите с одноразовой иглы бумажную наклейку. Аккуратно и плотно накрутите иглу на шприц-ручку.
С Снимите внешний колпачок иглы и отложите его в сторону, не выбрасывая.
D Снимите внутренний колпачок иглы и выбросьте его.
При каждой инъекции всегда используйте новую иглу во избежание контаминации.
Соблюдайте меры предосторожности в обращении с иглой, чтобы не допустить изгиба или повреждения иглы перед её использованием.
Никогда не надевайте внутренний колпачок на иглу вновь, если вы уже сняли его. Данная мера уменьшает риск случайного укола иглой.
Проверка работы шприц-ручки
Всегда производите проверку работы шприц-ручки, как показано ниже, прежде, чем использовать новую шприц-ручку для инъекций.
Е Поворачивайте селектор дозировки до тех пор, пока в индикаторном окошке символ проверки работы не поравняется с указателем дозировки.
F Держа шприц-ручку иглой вверх, несколько раз постучите по картриджу пальцем, чтобы пузырьки воздуха переместились в верхнюю часть картриджа.
G Удерживая шприц-ручку иглой вверх, нажимайте пусковую кнопку до тех пор, пока в индикаторном окошке напротив указателя дозировки не появится 0 мг. Последовательно повторяйте операции Е - G до тех пор, пока на конце иглы не появится капля лираглутида. Если после 6 повторов указанных операций капля препарата на конце иглы так и не появилась, поменяйте иглу на новую и вновь повторите операции Е — G, но не более 6 раз. Если после 6 повторов капля препарата на конце иглы так и не появилась, это означает, что шприц-ручка неисправна и вам следует использовать новую шприц-ручку.
В случае, если вы уронили шприц-ручку на твёрдую поверхность или у вас появились сомнения в её полной исправности, прежде, чем начать введение препарата, прикрутите новую одноразовую иглу и осуществите проверку работы шприц-ручки.
Установка дозы
Прежде всего, удостоверьтесь, что в индикаторном окошке 0 мг находится напротив указателя дозировки.
Н Поворачивайте селектор дозировки до тех пор, пока нужная Вам доза (0,6мг, 1,2мг или 1,8 мг) в индикаторном окошке не поравняется с указателем дозировки (mg означает мг).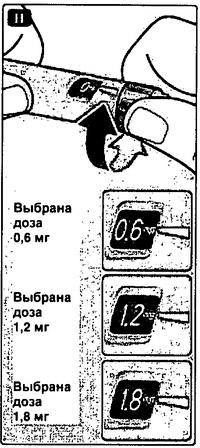
Исправить ошибочно установленную дозу можно путём вращения селектора дозировки вперёд или назад до тех пор, пока цифры нужной вам дозы в индикаторном окошке не поравняются с указателем дозировки. При вращении селектора дозировки назад соблюдайте осторожность, чтобы случайно не нажать на пусковую кнопку, во избежание выброса дозы лираглутида. Если селектор дозировки остановился до того, как в индикаторном окошке напротив указателя дозировки появилась нужная Вам доза, это означает, что оставшегося в шприц-ручке лираглутида не хватает для введения полной дозы. В таком случае Вам следует выполнить одно из двух описанных ниже действий:
Ввести нужную дозу в два приёма:
Вращайте селектор дозировки в любом направлении до тех пор, пока доза 0,6 мг или 1,2 мг не окажется напротив указателя дозировки. Сделайте инъекцию. Подготовьте новую шприц-ручку для второй инъекции и введите остаток дозы препарата (в миллиграммах) для того, чтобы завершить введение полной дозы.
Сделать инъекцию полной дозы препарата с помощью новой шприц-ручки:
Если селектор дозировки остановился до того, как в индикаторном окошке напротив указателя дозировки появились цифры 0,6 мг, подготовьте для инъекции новую шприц-ручку и введите полную дозу препарата с помощью новой шприц-ручки.
Селектор дозировки при вращении издаёт щелчки. Не используйте эти щелчки для отмеривания дозы лираглутида, необходимой Вам для инъекции.
Не используйте шкалу картриджа для отмеривания дозы лираглутида для инъекции - она показывает недостаточно точные значения.
Не пытайтесь выбрать другие дозы, кроме доз 0,6 мг, 1,2 мг или 1,8 мг. Цифры в индикаторном окошке должны находиться точно напротив указателя дозировки - такое положение гарантирует, что вы получите правильную дозу препарата.
Введение препарата
Введите иглу под кожу, используя технику инъекций, рекомендованную Вашим врачом или медсестрой. Затем следуйте инструкциям, данным ниже:
I Нажмите пусковую кнопку до упора, пока в индикаторном окошке напротив указателя дозировки не появится 0 мг. Будьте осторожны: не дотрагивайтесь пальцами до индикаторного окошка и не нажимайте на селектор дозировки это может вызвать блокировку механизма шприц-ручки. Держите пусковую кнопку в нажатом до упора состоянии, а иглу под кожей в течение минимум 6секунд. Это обеспечит введение полной дозы препарата.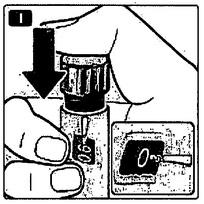
J Извлеките иглу из-под кожи. Вы можете увидеть каплю лираглутида на конце иглы. Это нормальное явление, которое никак не влияет на дозу препарата, которую вы только что ввели.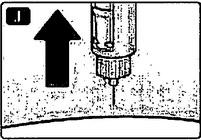
К Введите конец иглы внутрь внешнего колпачка иглы, не дотрагиваясь до него.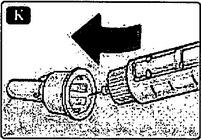
L Когда игла находится в колпачке, осторожно подтолкните внешний колпачок иглы вперёд, чтобы игла полностью вошла в него. Затем отвинтите иглу. Выбросьте иглу, соблюдая меры предосторожности, и закройте шприц-ручку колпачком. Если же шприц-ручка пуста, отвинтите иглу и выбросьте пустую шприц-ручку без иглы. Соблюдайте местные требования к утилизации использованных медицинских материалов.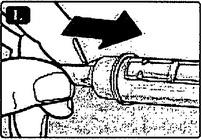
Удаляйте использованную иглу после каждой инъекции и не храните Вашу шприц-ручку Виктоза® с присоединенной иглой.
Это поможет предотвратить загрязнение, инфицирование и утечку лираглутида из шприц-ручки. Кроме того, это обеспечит точность дозировки.
Лица, осуществляющие уход за пациентом, должны соблюдать общие меры предосторожности при работе с использованными иглами во избежание риска случайного укола иглой.
Уход за шприц-ручкой Виктоза®
Шприц-ручка Виктоза® предназначена для точного и безопасного использования, и вы должны обращаться с ней с осторожностью:
• Не пытайтесь самостоятельно починить шприц-ручку или разобрать её на части.
• Предохраняйте шприц-ручку от попадания пыли, загрязнений и всех видов жидкостей.
• Шприц-ручку можно очищать тканью, смоченной мягким моющим средством. Не погружайте шприц-ручку в воду, не мойте и не смазывайте её, так как это может повредить механизм.
Важная информация
• Шприц-ручка Виктоза® предназначена для индивидуального использования не передавайте свою шприц-ручку другим лицам.
Храните шприц-ручку Виктоза® в недоступном для всех, а в особенности для детей, месте.


Отзывы и комментарии
У меня плохой отзыв.
У меня плохой отзыв.
Колола виктозу месяц по назначению врача эндокринолога (диагноз диабет 2 типа), но ощутимого результата не почувствовала. Купилась на уговоры врача, обещавшего от этого лекарства снижение давления и похудения - эффекта 0! Анализы тоже лучше не стали. Вот в понедельник снова иду на прием, пусть что-нибудь нормальное назначает, а не эту ерунду по бешеной цене.
Не может быть . Эффект
Не может быть . Эффект наступает через 3недели с глукофажем 500 Люнг после глюкофаж надо снижать
Результат очень хороший минус
Результат очень хороший минус 30 кг. Здоровье стало намного лучше, но это за два года применения. Анализы стали лучше, но в комплексе с другими препаратами и четкой диетой.
Добавить отзыв или комментарий