ИНСТРУКЦИЯ по применению лекарственного препарата для медицинского применения, ПУРЕГОН®
Регистрационный номер: ЛС-001649-250815
Торговое название: Пурегон®
Международное непатентованное название: фоллитропин бета
Лекарственная форма: раствор для внутримышечного и подкожного введения
Состав:
Активное вещество:
Один флакон (0,5 мл) содержит; фоллитропин бета 100 МЕ, 150 МЕ, 200 МЕ. Один флакон содержит соответственно 10, 15, 20 мкг протеина (специфическая биологическая активность in vivo равна приблизительно 10 000 МЕ ФСГ/мг протеина).
Вспомогательные вещества: сахароза 25,0 мг, натрия цитрата дигидрат 7,35 мг, метионин 0,25 мг, полисорбат 20 0,1 мг, хлористоводородная кислота 0,1 н или натрия гидроксид 0,1 н до рН 7, вода для инъекций до 0 5 мл.
Описание: прозрачный, бесцветный раствор
Фармакотерапевтическая группа: фолликулостимулирующее средство
Код АТХ: G03GA06
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Фармакодинамика
Препарат Пурегон® содержит рекомбинантный фолликулостимулирующий гормон (ФСГ), который получают при помощи технологии рекомбинантных ДНК, используя культуру клеток яичников китайского хомячка, в которые вставлены гены субъединиц человеческого ФСГ. Первичная аминокислотная последовательность рекомбинантной ДНК идентична таковой натурального человеческого ФСГ. При этом существуют небольшие различия в структуре углеводородной цепи. ФСГ обеспечивает нормальный рост и созревание фолликулов и синтез половых стероидных гормонов. Уровень ФСГ у женщин является фактором, определяющим начало и длительность развития фолликулов, а также их количество и время созревания. Таким образом, препарат Пурегон® может применяться для стимуляции развития фолликулов и синтеза эстрогенов при некоторых нарушениях функций яичников. Кроме того, препарат Пурегон® используется для индукции множественного развития фолликулов при проведении искусственного оплодотворения (например, в методиках экстракорпорального оплодотворения/пересадки эмбриона (ЭКО/ПЭ), при внутриматочной инсеминации (ВМИ) и интрацитоплазматической инъекции сперматозоидов (ИЦИС)). После лечения препаратом Пурегон ® для индукции конечной стадии созревания фолликула, возобновления мейоза и овуляции обычно вводят хорионический гонадотропин человека (ХГЧ).
Фармакокинетика
После внутримышечного или подкожного введения препарата Пурегон® максимальная концентрация ФСГ в плазме крови достигается в течение 12 часов.
У мужчин после внутримышечной инъекции препарата Пурегон® максимальная концентрация ФСГ достигается быстрее, чем у женщин. Благодаря постепенному выделению препарата из области инъекции и длительному периоду полувыведения (от 12 до 70 часов, в среднем 40 часов) содержание ФСГ остаётся повышенным в течение 24-48 часов, в связи с чем, повторное введение той же дозы ФСГ приводит к дальнейшему увеличению концентрации ФСГ в 1,5-2 раза по сравнению с однократным введением. Это позволяет достичь терапевтической концентрации ФСГ в крови.
Фармакокинетические показатели после внутримышечного и подкожного введения препарата Пурегон® существенно не отличаются. При обоих путях введения биодоступность препарата составляет примерно 77 %. Рекомбинантный ФСГ биохимически сходен с ФСГ, выделенным из мочи человека, и сходно с ним распределяется, метаболизируется и выводится из организма.
Показания
Лечение бесплодия у женщин в следующих случаях:
- ановуляция (включая синдром поликистозных яичников (СПКЯ) у женщин, нечувствительных к лечению кломифеном);
- индукция суперовуляции для индукции множественного развития фолликулов при проведении искусственного оплодотворения (например, в методиках ЭКО/ПЭ, ВМИ и ИЦИС).
Лечение бесплодия у мужчин в случае недостаточности сперматогенеза при гипогонадотропном гипогонадизме.
Противопоказания
Для мужчин и женщин
- гиперчувствительность к любому из компонентов препарата;
- опухоли яичников, молочной железы, матки, яичек, гипофиза и гипоталамуса;
- первичный гипогонадизм;
- заболевания щитовидной железы, надпочечников или гипофиза в стадии декомпенсации;
- выраженное нарушение функции печени и почек.
Дополнительно для женщин
- влагалищные и маточные кровотечения неустановленной этиологии;
- кисты яичников или увеличение яичников, не связанные с СПКЯ;
- пороки развития половых органов, несовместимые с беременностью;
- миома матки, несовместимая с беременностью;
- беременность, период лактации.
Применение в период беременности и грудного вскармливания
Применение препарата Пурегон® во время беременности противопоказано. В связи с тем, что клинических данных по применению препарата при беременности недостаточно, то в случае непреднамеренного введения в период беременности нельзя исключить тератогенный эффект рекомбинантного ФСГ.
Лактация
По результатам, полученным из клинических исследований или испытаний на животных, в настоящее время нет достаточной информации о проникновении фоллитропина бета в грудное молоко. Маловероятно, что фоллитропин бета выделяется с грудным молоком из-за его высокой молекулярной массы. При проникновении фоллитропина бета в грудное молоко, он будет разрушаться в желудочно-кишечном тракте ребенка. Фоллитропин бета может повлиять на секрецию молока.
Способ применения и дозы
Начинать лечение препаратом Пурегон® следует под наблюдением врача, имеющего опыт в лечении бесплодия.
Первое введение препарата Пурегон® должно проводиться под непосредственным наблюдением врача.
Применение у женщин
Доза должна подбираться индивидуально в зависимости от ответа яичников, под контролем УЗИ и концентрации эстрадиола в плазме.
Препарат Пурегон® эффективен при меньшей суммарной дозе и меньшем времени лечения, необходимых для созревания, по сравнению с ФСГ, получаемым из мочи, что сводит к минимуму риск развития гиперстимуляции яичников.
Суммарный опыт в лечении бесплодия путём экстракорпорального оплодотворения свидетельствует о том, что успех наиболее вероятен в течение первых 4 курсов терапии и в дальнейшем постепенно снижается.
Ановуляция
Рекомендуется последовательная схема лечения, начинающаяся с ежедневного введения 50 ME препарата Пурегон® в течение, по крайней мере, 7 дней. При отсутствии ответа яичников суточную дозу постепенно увеличивают до достижения роста фолликулов и/или увеличения концентрации эстрадиола в плазме, свидетельствующих о достижении оптимального фармакодинамического ответа. Оптимальным считается ежедневное повышение концентрации эстрадиола в плазме на 40-100 %.
Полученную таким образом ежедневную дозу затем поддерживают до достижения состояния предовуляции. Состояние предовуляции определяется по наличию доминантного фолликула диаметром не менее 18 мм (по данным УЗИ) и/или концентрации эстрадиола в плазме крови 300-900 пг/мл (1000-3000 пмоль/л).
Как правило, для достижения этого состояния требуется 7-14 дней лечения. После этого введение препарата прекращают и индуцируют овуляцию введением ХГЧ. Если количество фолликулов слишком велико или концентрация эстрадиола увеличивается слишком быстро, т.е. более чем в 2 раза за сутки в течение 2-3 последовательных дней, то ежедневную дозу следует уменьшить. Поскольку каждый фолликул диаметром более 14 мм является предовуляторным, наличие нескольких фолликулов диаметром более 14 мм несёт риск множественной беременности. В этом случае ХГЧ не вводят и принимают меры к предохранению от возможной беременности для предотвращения многоплодной беременности.
Индукция суперовуляции при проведении искусственного оплодотворения
Применяют различные схемы стимуляции. В течение, по крайней мере, 4 первых дней рекомендуется вводить 100-225 МЕ препарата. После этого дозу можно подбирать индивидуально, исходя из реакции яичников. В клинических исследованиях было показано, что обычно бывает достаточно поддерживающей дозы 75-375 МЕ в течение 6-12 дней, однако в некоторых случаях может потребоваться и более длительное лечение. Препарат Пурегон® можно применять либо изолированно, либо в комбинации с агонистом или антагонистом гонадотропин-рилизинг гормона (ГнРГ) для предотвращения преждевременного пика овуляции. При применении агонистов ГнРГ могут потребоваться более высокие суммарные дозы препарата Пурегон®.
Реакцию яичников контролируют путём УЗИ и определения концентрации эстрадиола в плазме. При наличии, по крайней мере, 3 фолликулов диаметром 16-20 мм (по данным УЗИ) и наличии хорошей реакции яичников (концентрации эстрадиола в плазме крови 300-400 пг/мл (1000-1300 пмоль/л) на каждый фолликул диаметром более 18 мм), индуцируют конечную фазу созревания фолликула путём введения ХГЧ. Через 34-35 часов проводят аспирацию яйцеклеток.
Применение у мужчин
Препарат Пурегон® следует применять у мужчин в дозе 450 МЕ в неделю, предпочтительно разделив дозу на три введения в неделю по 150 МЕ. Лечение необходимо проводить в комбинации с ХГЧ. Совместное применение препарата Пурегон® и ХГЧ должно продолжаться не менее 3-4 месяцев до улучшения показателей сперматогенеза. Чтобы оценить эффективность лечения, необходимо провести анализ спермы через 4-6 месяцев после начала лечения. В случае отсутствия улучшения комбинированная терапия может быть продолжена. Текущий клинический опыт применения препарата показывает, что для улучшения показателей сперматогенеза необходимо проводить лечение до 18 месяцев и более.
СПОСОБ ПРИМЕНЕНИЯ
Для предотвращения болезненных ощущений при инъекции и для сведения к минимуму утечки препарата из места инъекции раствор следует медленно вводить внутримышечно или подкожно. Необходимо чередовать участки подкожного введения, чтобы избежать развития жировой атрофии.
Неиспользованный раствор следует уничтожить.
Подкожные инъекции препарата Пурегон® может проводить сама женщина или её партнёр, предварительно получив подробные инструкции от врача. Самостоятельное введение препарата допустимо только для пациентов, имеющих хорошие навыки выполнения инъекций и постоянную возможность консультации со специалистом.
Инструкции по введению препарата
Этап 1. Подготовка шприца
Для введения препарата следует применять одноразовые стерильные шприцы и иглы. Объём шприца должен быть достаточно мал, чтобы ввести назначенную дозу точно. Если раствор непрозрачен или содержит механические включения, его нельзя использовать. Содержимое флакона должно быть использовано сразу после прокалывания резиновой пробки. Оставшийся после однократного применения раствор выбрасывают.
Сначала удаляют клапан крышки флакона. Надевают иглу на шприц и прокалывают иглой резиновую пробку флакона (а). Набирают раствор в шприц (b) и заменяют иглу на иглу для инъекций (с). Держа шприц иглой вверх, осторожно постукивают по нему сбоку для вытеснения пузырьков воздуха в верхнюю часть шприца, затем надавливают на поршень до полного удаления воздуха, пока в шприце не останется только раствор препарата Пурегон® (d). При необходимости дополнительным надавливанием на поршень устанавливают объём предназначенного для введения раствора.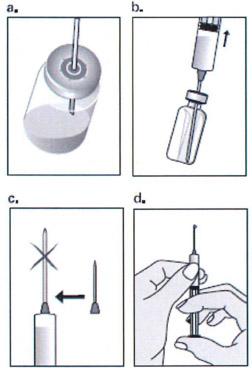
Этап 2. Место введения
Наиболее подходящее место для подкожного введения область живота вокруг пупка (е) с подвижной кожей и прослойкой жировой клетчатки. При каждой инъекции немного меняйте место введения. Можно вводить препарат в другие участки тела.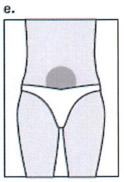
Этап 3. Подготовка участка введения
Для уменьшения неприятных ощущений при введении иглы можно сделать несколько хлопков по месту предполагаемой инъекции. Вымойте руки и протрите место введения инъекции дезинфицирующим раствором (например, 0,5% раствором хлоргексидина) для удаления поверхностных бактерий. Обработайте примерно 6 см вокруг предполагаемого места введения иглы и подождите примерно минуту, чтобы дезинфицирующий раствор высох.
Этап 4. Введение иглы
Немного оттяните кожу. Другой рукой введите иглу под углом 90° под поверхность кожи.
Этап 5. Проверка правильности положения иглы
При правильном положении иглы поршень довольно трудно вернуть назад. Если кровь проникает в шприц, это свидетельствует о том, что игла проткнула вену или артерию. В этом случае выньте шприц, накройте место инъекции тампоном с дезинфицирующей жидкостью и надавите, при этом кровотечение должно прекратиться за 1 — 2 минуты. Не используйте данный раствор и удалите его из шприца. Начните опять с этапа 1, используя новые иглу, шприц и флакон препарата.
Этап 6. Введение раствора
Опускайте поршень медленно, чтобы правильно ввести раствор и не повредить ткани кожи.
Этап 7. Извлечение шприца
Быстро извлеките иглу шприца из места инъекции, накройте место введения тампоном с дезинфицирующей жидкостью и надавите. Осторожный массаж этого места (при неизменном надавливании) способствует распределению раствора препарата Пурегон® в тканях и поможет избежать неприятных ощущений.
Побочное действие
Применение препарата Пурегон® может сопровождаться развитием местных реакций, которые наблюдались у 3 из 100 пациентов, получавших лечение препаратом Пурегон®. Большинство из этих местных реакций являются умеренными и быстропроходящими. Генерализованные реакции гиперчувствительности встречались у 2 из 1000 пациентов, получавших лечение препаратом Пурегон®.
Женщины
В таблице перечислены побочные действия препарата Пурегон®, описанные в клинических исследованиях с участием женщин, в соответствии с классом систем органов и частотой: частые (от ≥ 1/100 до < 1/10), нечастые (от ≥ 1/1000 до < 1/100).
| Системно-органный класс | Частота | Нежелательная реакции |
| Нарушения со стороны нервной системы | Часто | Головная боль |
| Нарушения со стороны желудочно-кишечного тракта | Часто | Чувство распирания в животе, боль в животе |
| Нечасто | Дискомфорт в животе, запор, диарея, тошнота | |
| Нарушения со стороны репродуктивной системы и молочной железы |
Часто | СГЯ*, боль в малом тазу |
| Нечасто | Болезненность, боль в соске молочной железы и/или нагрубание молочных желез, метроррагия, киста яичника, увеличение яичника, перекрут кисты яичника, увеличение матки, влагалищные кровотечения |
|
| Общие расстройства и реакции в месте введения | Часто | Гематома, боль, покраснение, отек, зуд |
| Нечасто | Эритема, крапивница, сыпь, зуд |
* — гиперстимуляция яичников встречается примерно у 4 из 100 женщин, получающих лечение препаратом. Клиническими симптомами умеренной гиперстимуляции яичников являются тошнота, диарея, вздутие и боль в животе вследствие нарушения венозного кровообращения и раздражения брюшины, а также увеличение яичников за счёт кист. В редких случаях наблюдался выраженный синдром гиперстимуляции яичников (СГЯ), угрожавший жизни пациентки и характеризовавшийся наличием больших, склонных к разрыву кист яичников, асцитом, гидротораксом и увеличением массы тела за счёт задержки жидкости в организме. В редких случаях при лечении препаратом Пурегон® в комбинации с ХГЧ, также как и при применении с другими гонадотропными гормонами, СГЯ может сопровождаться развитием венозной или артериальной тромбоэмболии.
Кроме того, описаны самопроизвольный аборт, повышение вероятности развития многоплодной беременности и повышение вероятности эктопической беременности. Считается, что они связаны с проведением вспомогательных репродуктивных технологий или последующей беременностью.
Мужчины
В таблице перечислены побочные действия препарата Пурегон®, описанные в клинических исследованиях (30 мужчин), в соответствии с классом систем органов и частотой: частые (от ≥ 1/100 до < 1/10). Побочные реакции, зафиксированные только однократно, указаны как частые, так как единичный случай соответствует частоте выше 1 %.
| Системно-органный класс | Частота | Нежелательная реакция |
| Нарушения со стороны нервной системы | Часто | Головная боль |
| Нарушения со стороны кожи и подкожно-жировой клетчатки | Часто | Акне, сыпь |
| Нарушения со стороны репродуктивной системы и молочной железы | Часто | Эпидидимальная киста, гинекомастия |
| Общие расстройства и реакции в месте введения | Часто | Местные реакции, включая уплотнение и болезненность |
Передозировка
Данные об острой передозировке препарата Пурегон® отсутствуют. Высокие дозы ФСГ могут привести к гиперстимуляции яичников. Симптомы: см. раздел "Побочное действие".
Лечение: при появлении симптомов нежелательной гиперстимуляции (не связанной с индукцией суперовуляции при проведении экстракорпорального оплодотворения) введение препарата Пурегон® следует, прекратить. В этом случае следует принять меры к предохранению от развития беременности и отказаться от введения ХГ, что может усугубить нежелательные явления. Следует проводить лечение, направленное на устранение симптомов гиперстимуляции яичников.
Взаимодействие с другими лекарственными средствами
Одновременное применение препарата Пурегон® и кломифена может усилить реакцию яичников. После проведения десенситизации гипофиза с помощью агонистов ГнРГ для достижения достаточной реакции яичников может потребоваться более высокая доза препарата Пурегон®. Фармацевтически несовместим с другими лекарственными средствами.
ОСОБЫЕ УКАЗАНИЯ
• Препарат Пурегон® может содержать следы стрептомицина и/или неомицина. Эти антибиотики могут стать причиной развития реакции гиперчувствительности.
• Перед началом лечения супружеская пара с бесплодием должна быть обследована надлежащим образом. А именно, следует исключить гипотиреоз, недостаточность коры надпочечников, гиперпролактинемию, опухоли гипофиза или гипоталамуса. В случае необходимости провести лечение указанных заболеваний.
У женщин
• СГЯ — ятрогенное состояние, в основе которого лежит ответ яичников на экзогенное введение препаратов-индукторов овуляции, превышающий физиологические рамки. Клинические проявления и симптомы СГЯ легкой и средней тяжести: боль в животе, тошнота, диарея, легкое/среднее увеличение размеров яичников, кисты яичников. Клинические проявления и симптомы тяжелого СГЯ: кисты яичников большого размера, острые боли в животе, асцит, плевральный экссудат, гидроторакс, диспноэ, олигурия, гематологические нарушения, увеличение массы тела. СГЯ тяжелой степени может осложняться венозными и артериальными тромбозами и тромбоэмболиями. На фоне СГЯ отмечались случаи транзиторных нарушений функциональных проб печени, свидетельствующие о дисфункции органа как в сочетании с морфологическими изменениями по данным биопсии, так и без них.
СГЯ может быть вызван применением ХГЧ и беременностью (эндогенным ХГЧ). Обычно ранние проявления СГЯ отмечаются в течение 10 дней после применения ХГЧ. Эти явления связаны с чрезмерно выраженным ответом яичников на стимуляцию гонадотропином. Поздние проявления СГЯ отмечаются спустя более 10 дней после применения ХГЧ и происходят в результате изменений гормонального баланса на фоне беременности. Учитывая риск развития СГЯ в течение как минимум 2 недель после введения ХГЧ, требуется проведение мониторинга.
Женщины с известными факторами риска повышенного ответа яичников особенно склонны к развитию СГЯ на фоне либо после применения препарата Пурегон®. На фоне первого цикла стимуляции яичников, когда факторы риска известны лишь частично, требуется тщательный мониторинг ранней симптоматики СГЯ.
В целях уменьшения риска развития СГЯ целесообразно проведение УЗИ для оценки размера фолликулов до начала курса терапии и далее регулярно в течение всего курса терапии. Также необходимо параллельное определение концентрации эстрадиола в сыворотке. Для вспомогательных репродуктивных технологий (BPT) характерен повышенный риск СГЯ при наличии 18 и более фолликулов диаметром от 11 мм и более. При наличии 30 фолликулов и более рекомендуется воздержаться от применения ХГЧ.
Меры по уменьшению риска развития СГЯ в зависимости от выраженности ответа яичников
• Прекращение дальнейшей стимуляции гонадотропином с максимальным сроком до 3 дней.
• Отмена ХГЧ и прекращение терапевтического цикла.
• Для активации окончательного созревания яйцеклетки применение ХГЧ (хорионический гонадотропин человека, выделенный из мочи) в дозе ниже 10000 МЕ, например, 5000 ME ХГЧ, выделенного из мочи, или 250 мкг хориогонадотропина альфа, полученного путем рекомбинантной технологии, что эквивалентно примерно 6500 МЕ ХГЧ, выделенного из мочи.
• Отмена переноса эмбриона с последующей его криоконсервацией.
• Отмена ХГЧ для поддержки лютеиновой фазы.
• В случае развития СГЯ рекомендуется проведение стандартных терапевтических мероприятий.
• После терапии гонадотропинами, в том числе препаратом Пурегон®, сообщалось о случаях перекрута яичников. Перекрут яичников может быть связан и с другими факторами риска, например, с СГЯ, беременностью, наличием в анамнезе оперативных вмешательств в брюшной полости и перекрута яичника, наличием кист яичников / поликистоза в настоящее время либо в анамнезе. Повреждения яичников, связанные с уменьшением кровоснабжения, можно свести к минимуму при условии ранней диагностики и немедленного медицинского вмешательства.
• После применения гонадотропинов, в том числе препарата Пурегон®, сообщалось о тромбоэмболических явлениях, как связанных так и не связанных с СГЯ. Сосудистый тромбоз, как венозный, так и артериальный, может привести к уменьшению кровоснабжения жизненно важных органов либо конечностей. У женщин с известными факторами риска тромбоэмболических явлений (личный или семейный анамнез, выраженное ожирение, тромбофилия), применение гонадотропинов, в том числе препарата Пурегон®, может дополнительно увеличить риск развития СГЯ. В подобных случаях следует тщательно оценить риск и преимущества применения гонадотропинов, в том числе препарата Пурегон®. Следует отметить, что беременность также увеличивает риск тромбоза.
• На фоне применения гонадотропинов, в том числе препарата Пурегон®, зарегистрированы случаи многоплодной беременности с последующими родами. Во многих случаях при многоплодной беременности отмечался повышенный риск развития нежелательных явлений для матери (осложнения беременности и родов), а также со стороны новорожденного (низкий вес при рождении). Для сведения к минимуму риска многоплодной беременности у пациенток с ановуляцией при индукции овуляции целесообразно проведение трансвагинального УЗ контроля развития фолликулов. Также целесообразно определение концентрации эстрадиола в сыворотке крови. Пациенток следует проинформировать о риске развития многоплодной беременности до начала терапии.
• На фоне ВРТ риск многоплодной беременности в основном связан с количеством пересаженных эмбрионов. При индукции овуляции коррекция дозы ФСГ предотвращает множественный рост фолликулов.
• У женщин, которым проводят процедуры ВРТ, часто имеются аномалии маточных труб, в связи с чем, повышается риск развития эктопической беременности. Для таких пациенток важно раннее проведение УЗ исследования для подтверждения внутриматочной локализации плодного яйца.
• Частота врождённых пороков развития при применении ВРТ может быть несколько выше, чем при естественном оплодотворении. Возможно, это связано с особенностями родителей, например, возрастом матери или характеристиками спермы отца, а также с более высокой частотой развития многоплодной беременности при применении ВРТ. Указаний на то, что увеличение риска развития врождённых пороков связано с применением гонадотропинов, не выявлено.
• Сообщалось о случаях развития новообразований яичников и других органов репродуктивной системы, как доброкачественных, так и злокачественных, у женщин, которым проводились различные виды терапии в связи с бесплодием. На данный момент не установлено зависимости между применением гонадотропинов при лечении бесплодия и повышением риска развития новообразований у женщин.
• До начала применения препарата Пурегон® следует исключить медицинские состояния, при которых противопоказана беременность.
У мужчин
• Повышенные концентрации эндогенных ФСГ у мужчин свидетельствуют о первичной тестикулярной недостаточности. У таких пациентов комбинированная терапия препаратом Пурегон® и ХГЧ неэффективна.
Влияние на способность управлять автомобилем и работать с механизмами
Не обнаружено.
Форма выпуска
Раствор для внутримышечного и подкожного введения 100 МЕ/0,5 мл, 150 МЕ/0,5 мл, 200 МЕ/0,5 мл
По 0,5 мл во флакон из бесцветного стекла типа I (ЕФ) вместимостью 3 мл, укупоренный хлорбутиловой пробкой и обжатый алюминиевым колпачком с пластиковой крышечкой.
По 1 флакону, расположенному горизонтально, с инструкцией по применению в пачку картонную с фиксаторами для флакона
По 5 или 10 флаконов, расположенных вертикально, с инструкцией по применению в пачку картонную с разделителями между флаконами.
СРОК ГОДНОСТИ
3 года.
Не применять после истечения срока годности, указанного на упаковке.
Условия хранения
При температуре 2-8 °С, в защищенном от света месте, не замораживать.
Хранить в недоступном для детей месте.
Условия отпуска из аптек
По рецепту.
Владелец РУ
Н.В, Органон, Нидерланды
М.Ч. Organon, Kloosterstraat 6, 5349 АВ Oss, the Netherlands
Производитель/Выпускающий контроль качества
Н.В. Органон, Нидерланды
N.Ч, Organon, Kloosterstraat 6, 5349 АВ Oss, the Netherlands
Претензии потребителей направлять по адресу:
ООО «МСД Фармасьютикалс»
ул. Павловская, д. 7, стр. 1
г. Москва, Россия, 115093
тел.: (495) 916-71-00
факс: (495) 916-70-94


Добавить отзыв или комментарий